Für Betroffene, die bestimmte Veränderungen am Gen RPE65 aufweisen, ist erstmals eine Behandlungsmöglichkeit verfügbar: eine Gentherapie der Zellen in der Netzhaut.
Da sich sowohl die genetischen Ursachen als auch die Symptome der erblichen Netzhauterkrankungen unterscheiden, gibt es verschiedene Behandlungsansätze. Bisher geht es meist darum, das Sehen mit speziell angepassten, vergrößernden Brillen zu verbessern, die Umgebungsbedingungen zu optimieren sowie Komplikationen zu behandeln. Auch Orientierungs- und Mobilitätstrainings können für Unterstützung sorgen.1,2,3

Adobe Stock-205234468-Kzenon / Adobe Stock-228397707-whitehoune
Da erbliche Netzhauterkrankungen auf Veränderungen (Mutationen) des Erbguts beruhen, sind Gentherapien eine Behandlungsoption der Zukunft. Forscher arbeiten derzeit an verschiedenen Konzepten: Bei der sogenannten Gensupplementierung soll das defekte Gen durch eine intakte Kopie ersetzt werden. Dies ist insbesondere bei kleineren mutierten Gensequenzen anwendbar. Ein anderer Ansatz ist die „Genschere“ (CRISPR/Cas). Mit dieser Methode wird die DNA (das Erbgut) gezielt verändert. Es können Gene eingefügt, entfernt oder ausgeschaltet werden. Hier gibt es bereits vielversprechende Forschungsansätze für Retinitis pigmentosa.4 Weitere Therapien zur Behandlung erblicher Netzhauterkrankungen befinden sich in der Entwicklung.5 Welche Ansätze untersucht werden und welche Studien zu bestimmten Erkrankungen laufen, erfahren Sie zum Beispiel über ACHSE online, PRO RETINA oder Orphanet.
Für Betroffene, die mit Veränderungen in beiden Kopien des RPE65-Gens geboren wurden, wurde im November 2018 in der Europäischen Union eine Gentherapie zur Behandlung des Sehverlusts zugelassen. Sie kommt allerdings nur für sehr wenige Menschen infrage. Seit April 2019 ist die Therapie auch in Deutschland verfügbar.
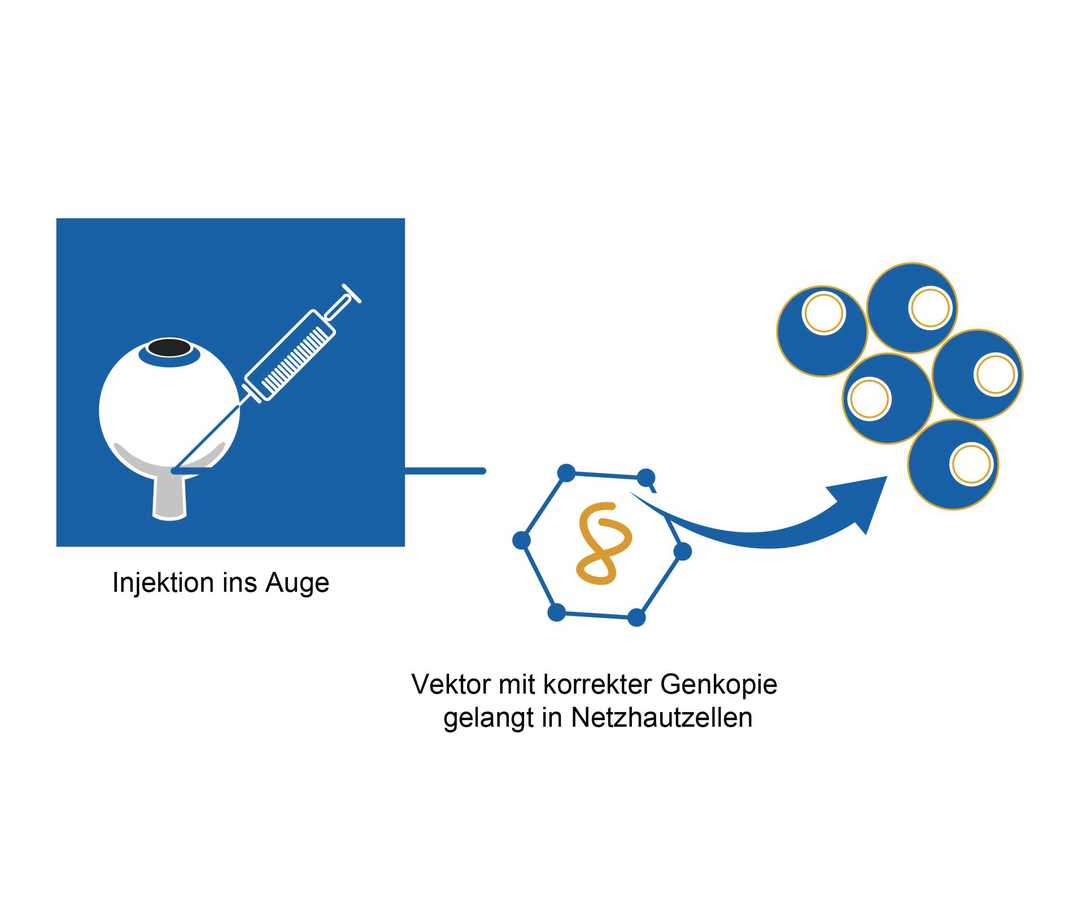
Wie läuft die Gentherapie der Netzhaut in der Praxis ab?
Die korrekten Genkopien werden mit einer Spritze unter die Netzhaut gebracht. Sie übernehmen die Funktion des defekten Gens in den Netzhautzellen, sodass das fehlende Protein wieder gebildet werden kann. Die Funktion der vorhandenen lichtempfindlichen Sehzellen kann dadurch wiederhergestellt werden. Die Behandlung kann die Erkrankung nicht heilen. Sie kann aber dazu beitragen, das Sehvermögen der Patienten zu verbessern und teilweise wiederherzustellen.7
Novartis
Wichtige Voraussetzung: der Gentest
Ob ein Patient für die Behandlung mit der zugelassenen Gentherapie geeignet ist, entscheidet der behandelnde Arzt. Dafür wird der Patient zunächst eingehend untersucht. Um zu erfahren, ob tatsächlich der behandelbare genetische Defekt vorliegt, wird schließlich ein Gentest durchgeführt. Wichtige Voraussetzung für diese spezielle Behandlung ist außerdem, dass der Patient noch über ausreichend lebensfähige Netzhautzellen verfügt.
Auch wenn nur wenige Patienten für die Gentherapie infrage kommen, ist eine genetische Testung bei erblichen Netzhauterkrankungen aus mehreren Gründen sinnvoll. So kann eine Gendiagnostik Aufschluss darüber geben, wie die individuelle genetische Erkrankung wahrscheinlich ablaufen wird.6 Durch die genetische Einordnung der Erkrankung können auch mögliche therapeutische Maßnahmen frühzeitig geklärt werden. Ein Gentest ermöglicht außerdem die Vorhersage, mit welcher Wahrscheinlichkeit die Erkrankung weitervererbt werden kann. Auch mit Blick auf weitere Gentherapien, die sich derzeit in der Entwicklung befinden, ist die genetische Testung aller Patienten mit erblicher Netzhauterkrankung sinnvoll: Nach der Testung können Patienten ihre Daten anonymisiert auf Portalen, etwa dem Patientenregister von PRO RETINA, eingeben. Damit können sie für die Teilnahme an einer klinischen Studie zu möglichen neuen Wirkstoffen oder neuen Behandlungsmethoden identifiziert werden. Patienten mit den typischen Symptomen einer erblichen Netzhauterkrankung sollten sich an ein darauf spezialisiertes Zentrum für Augenheilkunde wenden.
Hintergrund
Was ist eine Gentherapie?
Fortschritte in der Zell- und Gentherapie könnten die Medizin revolutionieren – und viele Patienten mit bisher nicht oder kaum zu behandelnden Erkrankungen könnten in Zukunft davon profitieren.
Schätzungen zufolge leiden weltweit 400 Millionen Menschen an mehr als 5.000–8.000 seltenen Erkrankungen, die jeweils durch die Mutation eines einzelnen Gens hervorgerufen werden.8
Die „klassische“ Gentherapie zielt auf Krankheiten ab, die jeweils von defekten oder fehlenden Genen meist schon von Geburt an verursacht werden. Dann fehlt dem Körper in der Regel ein wichtiger Baustein (Protein oder Enzym), und der Stoffwechsel funktioniert nicht mehr richtig. Die Gentherapie versucht, dieses fundamentale Problem zu lösen.
Novartis
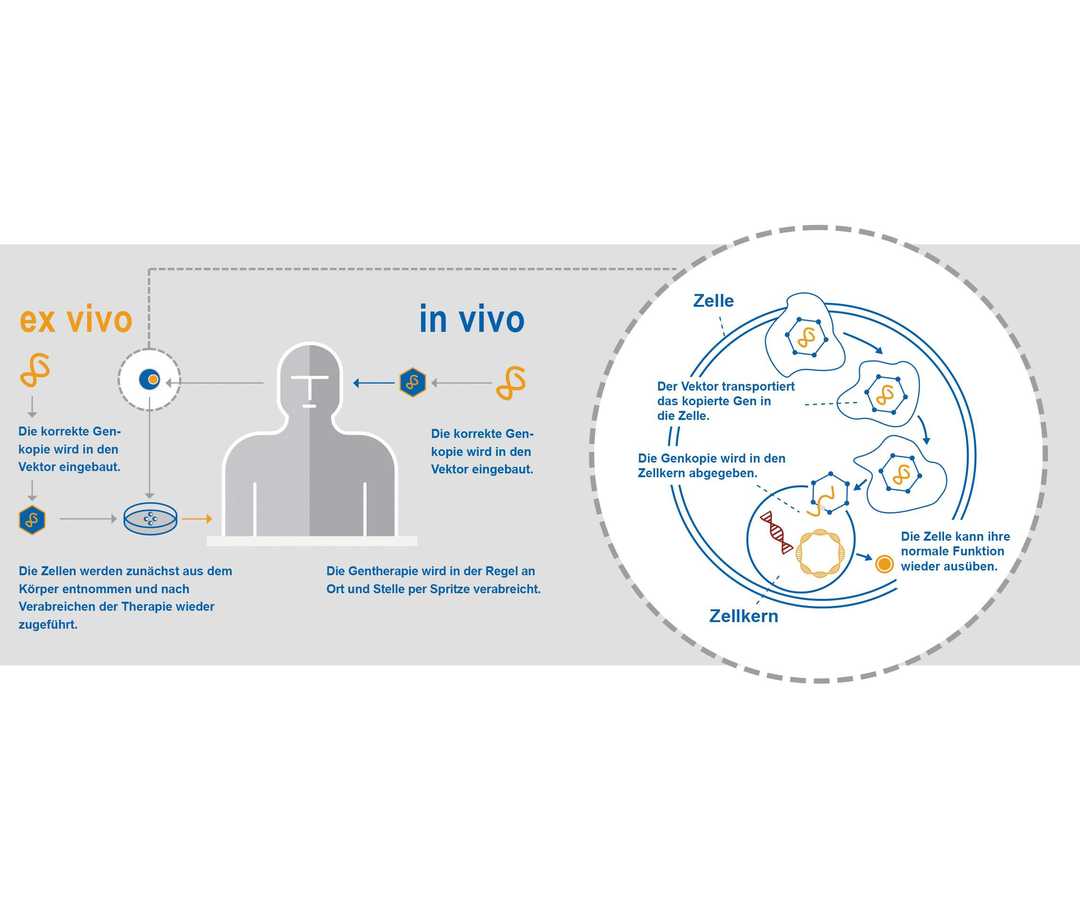
Wie funktioniert eine Zell- oder Gentherapie?
Zell- oder Gentherapien zielen darauf ab, genetische Erkrankungen zu behandeln, indem sie zum Beispiel ein oder mehrere mutierte Gene entfernen, reparieren oder durch korrekte Versionen ersetzen. Diese können dazu in spezielle Transporter verpackt werden – sogenannte Vektoren. Sie können in Körperzellen eindringen und die korrekte Genkopie in den Zellkern abgeben.9 Dieser Vorgang kann außerhalb des Körpers geschehen (ex vivo), wie z. B. bei den Zelltherapien, oder innerhalb (in vivo).9 Sobald den Zellen wieder eine intakte Genkopie zur Verfügung steht, können sie ihre normale Funktion wieder ausüben.9
Welche Methoden des Gentransfers gibt es?
Mit dem Begriff Gentransfer bezeichnet man die Übertragung von einem oder mehreren Genen in eine Empfängerzelle. Dazu dienen verschiedene Verfahren (auch ausgelegt auf die verschiedenen Zelltypen), die die Zellwände von Bakterien für die hinzugefügte DNA durchlässig machen bzw. Fremd-DNA in eine Zelle einbringen.10 Zu den gängigsten Methoden zählen folgende:
Chemischer Transfer11
Die korrekte Genkopie wird zusammen mit einer elektrisch geladenen Verbindung zu den Zellen gebracht. Dabei wird die Struktur der Zellmembran durch die elektrisch geladene Verbindung gestört, wodurch die neue DNA ins Zellinnere gelangt.
Physikalischer Transfer11
Bei einem physikalischen Transfer gibt es drei Möglichkeiten:
-
Mit einer Mikroinjektion wird eine speziell geformte Glaskanüle, die mit der zu übertragenden Substanz gefüllt ist, unter dem Mikroskop in die Zelle eingeführt. Die Chance für einen erfolgreichen Einbau ist hierbei besonders hoch. Allerdings muss jede Zelle einzeln behandelt werden.
-
Mit einer Elektroporation macht ein Stromstoß die Zellmembran vorübergehend durchlässig. Somit kann die korrekte Genkopie in die Zelle eindringen. Bei dieser Methode besteht allerdings die Gefahr, dass die Zellen stark beschädigt werden.
-
Mithilfe einer sogenannten Genkanone (particle gun) werden Goldkügelchen in die Zelle geschossen. Auf der Oberfläche der Kügelchen haftet dabei die korrekte Genkopie. Auch hier kann es zu Zellschäden kommen.
Transduktion11
Eine Transduktion ist ein Gentransfer durch unschädliche Viren. Dabei bringt das Virus die korrekte Genkopie in die Zelle.
Genschere (CRISPR/Cas)12
Die Genschere ist ein neues Verfahren, um Bausteine der DNA im Erbgut zu verändern. Sie funktioniert in allen lebenden Zellen und Organismen. Dieses Verfahren macht es möglich, einzelne Gene umzuschreiben oder zu bearbeiten.
Das könnte Sie auch interessieren

Adobe Stock-271142195-fizkes
Meine Fragen
Erbliche Netzhauterkrankung – was bedeutet das für Ihr Kind? Hier bekommen Sie Antworten auf Ihre Fragen.

Novartis
Die Patientenbroschüre
Hier bekommen Sie wichtige Informationen über die Erkrankung Ihres Kindes, die Diagnose und den Gentest.

Novartis
Der Arztbesuch
Mit dieser Checkliste haben Sie Ihre Termine und Fragen an den Augenarzt und Humangenetiker stets im Blick.
Quellen:
- Finger RP, et al. Blindheit und Sehbehinderung in Deutschland. Dtsch Arztebl Int 2012; 109(27-28): 484-9. doi: 10.3238/arztebl.2012.0484 (zuletzt aufgerufen am 14.08.2025).
- Sharif W, Sharif Z. Leber's congenital amaurosis and the role of gene therapy in congenital retinal disorders. Int J Ophthalmol. 2017 Mar 18;10(3):480–484. doi: 10.18240/ijo.2017.03.24 (zuletzt aufgerufen am 14.08.2025).
- Scholl HPN, et al. Safety and Proof-of-Concept Study of Oral QLT091001 in Retinitis Pigmentosa Due to Inherited Deficiencies of Retinal Pigment Epithelial 65 Protein (RPE65) or Lecithin:Retinol Acyltransferase (LRAT). PLoS One. 2015 Dec 10;10(12):e0143846. doi: 10.1371/journal.pone.0143846 (zuletzt aufgerufen am 14.08.2025).
- Böhm S, et al. A gene therapy for inherited blindness using dCas9-VPR-mediated transcriptional activation. Sci Adv. 2020 Aug 19;6(34):eaba5614. doi: 10.1126/sciadv.aba5614 (zuletzt aufgerufen am 14.08.2025).
- Ziccardi L, et al. Gene Therapy in Retinal Dystrophies. Int J Mol Sci. 2019 Nov 14;20(22):5722. doi: 10.3390/ijms20225722 (zuletzt aufgerufen am 14.08.2025).
- Bolz HJ. Next-Generation Sequencing: Quantensprung für Forschung und Diagnostik in der Ophthalmologie. Klin Monbl Augenheilkd. 2017 Mar;234(3):280-288. doi: 10.1055/s-0043-103962 (zuletzt aufgerufen am 14.08.2025).
- Mayo Clinic. First FDA-approved retinal gene therapy available at Mayo Clinic. https://www.mayoclinic.org/medical-professionals/ophthalmology/news/first-fda-approved-retinal-gene-therapy-available-at-mayo-clinic/mac-20575863 (zuletzt aufgerufen am 14.08.2025).
- National Human Genome Research Institute. Genetics vs. Genomics Fact Sheet. https://www.genome.gov/about-genomics/fact-sheets/Genetics-vs-Genomics (zuletzt aufgerufen am 14.08.2025).
- High KA. The Jeremiah Metzger Lecture: gene therapy for inherited disorders: from Christmas disease to Leber's amaurosis. Trans Am Clin Climatol Assoc. 2009:120:331-59. https://pubmed.ncbi.nlm.nih.gov/19768188/ (zuletzt aufgerufen am 14.08.2025).
- Gentechniken. Gentransfer – Gene in Bewegung. https://gentechniken.de/gentransfer/ (zuletzt aufgerufen am 14.08.2025).
- DocCheck Flexikon. Gentherapie. https://flexikon.doccheck.com/de/Gentherapie (zuletzt aufgerufen am 14.08.2025).
- transGEN. Nobelpreis 2020. Was man zur Gen-Schere CRISPR/Cas wissen sollte. https://www.transgen.de/forschung/2564.crispr-genome-editing-pflanzen.html (zuletzt aufgerufen am 14.08.2025).